|
醇與催化劑混合後,倒入反應器內,然後加入油脂,再將反應器封閉,以防止醇之損失,並將反應溫度設定稍高於醇之沸點溫度,以加速轉酯化反應。(National Biodiesel Board, 2002)
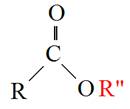
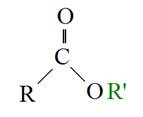
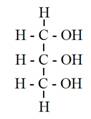
所謂轉酯化反應是指油脂(RCOOR”)與醇類(R’OH)在某一比例下混合、反應,產製出另外一種酯類(RCOOR’)之過程(圖5-3-1)。以產製生質柴油之油脂原料為例,其最主要之成份為三酸甘油酯,當三酸甘油酯與高純度之甲醇進行轉酯化反應後,即生成脂肪酸甲酯(Fatty Acid Methyl Esters;FAME),也就是所謂之生質柴油(Biodiesel),還有甘油(副產物)。如圖5-3-2所示。
|
+ |
R’OH |
<-> |
|
+ |
R”OH |
酯 |
|
醇 |
|
酯 |
|
醇 |
圖5-3-1 轉酯化反應之過程
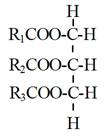
|
+ |
CH3OH |
--> |

|
+ |
|
三酸甘油酯 |
|
甲醇 |
|
生質柴油 |
|
甘油 |
100 lbs of oil + 10 lbs of Methanol ←→ 100 lbs of biodiesel + 10 lbs of glycerol |
圖5-3-2 三酸甘油酯與醇之轉酯化反應(Van Gerpen et al., 2004)
轉酯化反應為一可逆過程(Reversible process)(Freedman et al., 1986; Schwab et al., 1987),過程中,三酸甘油酯(TG)先與甲醇反應生成二酸甘油酯與第一個脂肪酸甲酯(FAME),接著二酸甘油酯(DG)再與甲醇反應生成單酸甘油酯(MG)與第二個脂肪酸甲酯,最後,單酸甘油酯再與甲醇反應生成最後一個脂肪酸甲酯與副產品甘油(圖5-3-3),即1莫耳(Moles)之三酸甘油酯與3莫耳之甲醇反應會產生3莫耳之脂肪酸甲酯與甘油。然而在實務上為了使反應得以完成,加入之甲醇量往往得超過理論值。
Triglyceride (TG) +R’OH→Diglyceride (DG) + R1COOR’
Diglyceride (DG) +R’OH→Monoglyceride (MG) + R2COOR’
Monoglyceride (MG) +R’OH→Glycerol (GL) + R3COOR’ |
圖5-3-3 三酸甘油酯與醇轉酯化反應生成脂肪酸甲酯與甘油之過程(Freedman, 1986)
轉酯化反應過程中,常加入適當之催化劑來加速反應之進行。
催化劑是一種能改變反應速率、或改變選擇率(主產物生成率對反應物消耗之比值)、改變反應路徑與改變反應溫度,卻不會在反應中消耗掉之物質,可分成勻相催化劑(Homogeneous Catalyst)與非勻相催化劑(Heterogeneous Catalyst),前者為可以和反應物均勻混合之催化劑,後者為與反應物不同相之催化劑時(例如反應物為液相或氣相,而催化劑卻為固相)。
習用於轉酯化反應之勻相催化劑包括硫酸(Sulfuric acid;H2SO4)、磷酸(Phosphoric acid;H3PO4)、鹽酸(Hydrochloric acid;HCl)等酸性催化劑(Acid catalyst),或氫氧化鈉(Sodium hydroxide;NaOH), 甲醇鈉(Sodium methoxide;NaOCH3)、氫氧化鉀(Potassium hydroxide;KOH), 甲醇鉀(Potassium methoxide;KOCH3)、氨基鈉(Sodium amide ;NaNH2)、氫化鈉(Sodium hydride ;NaH)、氨基鉀(Potassium amide;KNH2)、氫化鉀(Potassium hydride;KH)等鹼性催化劑(Alkali catalyst)。
【範例】
以黃豆油與甲醇(Methanol),並以氫氧化鉀(KOH)作為觸媒之轉酯化反應為例(Van Gerpen et al.,2004)(圖5-3-4),由於黃豆油主要成份為三油酸甘油酯(Triolein),因此理論之反應過程中,1莫耳之三油酸甘油酯與3莫耳之甲醇反應產生3莫耳之油酸甲酯(Methyl Oleate)與1莫耳之甘油。由於1莫耳之三油酸甘油酯含有57個碳原子、104個氫原子與16個氧原子,因此1莫耳三油酸甘油酯之重量為885.46公克(=57 × 12.0111(碳)+104 × 1.00797 (氫)+6 × 16.000 (氧)),同理,3莫耳之甲醇重96.12公克,故所產製之3莫耳油酸甲酯重量為889.50 公克,1莫耳之甘油重量為92.10公克。實務上,為了完成反應,所加入之甲醇量往往得超過理論值之60%至100%。圖5-3-5所示,為使用甲醇量超過100%時,三油酸甘油酯之轉酯化反應,其中,超量使用之甲醇成為反應產物之一部分,使得反應後之處理難度提高。
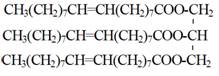
|
+ |
CH3OH |
KOH--> |
Triolein(885.46g) |
|
Methanol
(3 × 32.04=96.12g) |
|
3 CH3(CH2)7CH=CH(CH2)7COOCH3 |
+ |
|
Methyl oleate (biodiesel)
(3 × 296.50 = 889.50 g) |
|
Glycerol
(92.10g) |
圖5-3-4 三油酸甘油酯之轉酯化反應(Van Gerpen et al.,2004)
Catalyst
Triolein + 2X Methanol à Methyl oleate + Glycerol + XS Methanol
885.46 g 6 × 32.04 3 × 296.50 92.10 g 96.12 g |
圖5-3-5 使用超量甲醇之三油酸甘油酯轉酯化反應(Van Gerpen et al., 2004)
5.3.1 鹼性催化轉酯
鹼性催化劑之價格較便宜,反應速度較快,是目前最為普遍使用之催化劑。
使用鹼性催化劑之轉酯化反應,須先將鹼性催化劑,如氫氧化鈉(NaOH)或甲醇鈉(NaOCH3)溶解於醇中,產生R’O-陰離子,然後由R’O-陰離子將三酸甘油酯之C = O鍵打斷,使其暫時成為一個四面體結構之中間產物(Tetrahedral intermediate);該四面體中間產物繼續與醇反應,生成R’O-和另一個多了氫離子之四面體中間產物,該新生之中間產物經過重組便產生一個脂肪酸甲酯(FAME)和二酸甘油酯(DG)。
轉酯化反應機制(Reaction mechanism)如圖5-3-6所示。
由轉酯化反應機制可知,若使用氫氧化納作為催化劑,則會在溶解於醇時,產生局部之水分,這些水分會導致皂化反應,進而降低轉酯率,且增加後續產物分離與水洗程序之難度。若選擇甲醇鈉作為催化劑,則不會有水分產生之問題,但因甲醇納成本較高,使用上仍以氫氧化納為主。
p-step: |
OH-+R’OH←→R’O-+H2O or NaOR’ ←→R’O-+Na+ |
Step 1: |
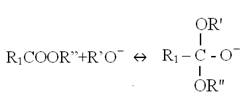
|
Step 2: |
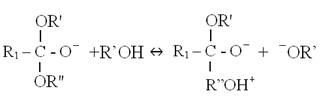
|
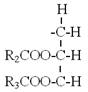
R”= |
|
R1、R2、R3=Carbon chain of fatty acid
R’=Alkyl group of alcohol |
圖5-3-6 鹼性催化劑下之轉酯化反應機制
除了有催化劑溶解於醇類釋出水分之問題外,對於油脂原料之酸值(Acid value)與含水率等條件也有一定之要求,才能維持較佳之轉酯效果。Wright等人(1944)指出:油脂之酸值必須低於1,否則就必須使用更多之氫氧化納才能中和油脂中之游離脂肪酸,且所有參與反應之反應物必須完全無水(Anhydrous),以免所含水分產生皂化反應。
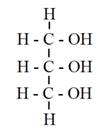
由於未經過精煉之原料油或廢棄之油炸油含有較高之游離脂肪酸與水分,比較不適合利用鹼性催化劑進行催化轉酯。其中,游離脂肪酸(Free Fatty Acid;FFA)在鹼性催化轉酯過程中,會與鹼性催化劑發生皂化反應,產生脂肪酸鹽(Fatty acid salts),即所謂之皂(Soap),如圖5-3-7所示,所產生之皂,將促使膠(Gel)之形成,增加反應物織黏度與後續產物分離之成本;至於所含水分,則會將三酸甘油酯(TG)水解(Hydrolyze)成二酸甘油酯(DG)與游離脂肪酸,而生成之游離脂肪酸則又進一步與催化劑產生皂化反應(圖5-3-8)。
R1COO-C-H(FFA)+ NaOH or MeONa
-->R1COO-C-Na(Soap)+ H2O or MeOH |
圖5-3-7 游離脂肪酸與鹼性催化劑反應產生皂與水
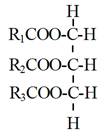
|
+ |
H2O |
--> |
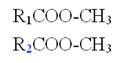
|
+ |
R3COOH |
三酸甘油酯 |
|
水 |
|
二酸甘油酯(DG) |
|
FFA |
圖5-3-8 水促成游離脂肪酸之形成(酯類水解得到脂肪酸)
依據Ma等人(1998a)之研究指出,水分對於轉酯化反應具有負面效應,且其負面效應程度高於游離脂肪酸之存在,以Beef tallow為例,水分含量不得超過0.06%(w/w),游離脂肪酸含量不得超過0.5%(w/w)。
5.3.2 酸性催化轉酯
生質柴油之售價較石化柴油高之理由之一,是因為使用之原料成本太高所導致,依估計,生質柴油之產製成本約有60~75%是來自於所使用之油脂原料,因此使用較為低廉之廢棄油炸油(Waste frying oils)或非食用油(Non-edible oils),被認為是降低生質柴油生產成本、提高生質柴油競爭力之方法之一。這些低成本之原料含有較多之游離脂肪酸,不宜使用鹼性催化劑,以免衍生更多之成本負擔。由於酸性催化劑之功能不會受到原料中游離脂肪酸存在之影響,且可以同步催化酯化(Esterification)與轉酯化(Transesterification),因此對游離脂肪酸含量超過1%之低成本原料而言,採用酸性催化劑是比較有效(More efficient)且比較經濟之方法。但到目前為止,鹼性催化轉酯仍是最為普遍使用之生質柴油至製程,其主要原因之一就是酸性催化轉酯之反應速度比鹼性催化劑慢約4000倍(Srivastava and Prasad, 2000)。
其中,在酸性催化劑作用下,羧酸(Carboxylic acid)與醇反應生成酯(Ester)之過程(圖十二),稱為酯化反應(Esterification)。首先,羧酸之Carbonyl group被酸性催化劑質子化(Protonized),質子化後之羧酸C = O鍵被打斷,而後經過質子移轉,再與醇反應生成一個四面體結構之中間產物(Tetrahedral intermediate),該中間產物經過二次重組後釋出水分子(H2O)與質子後,產生酯(RCOOR’),如圖5-3-9所示。
圖5-3-9 酸性催化劑下之酯化反應機制
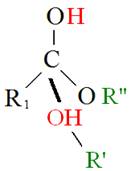
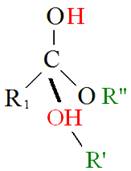
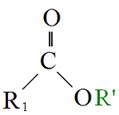
至於三酸甘油酯與醇反應產生脂肪酸甲酯與甘油之過程,則稱為轉酯化反應(Transesterification)。首先,三酸甘油酯之Carbonyl group被酸性催化劑質子化(Protonized),質子化後之三酸甘油酯C = O鍵被打斷,而後經過質子移轉,再與醇反應生成一個四面體結構之中間產物(Tetrahedral intermediate),該中間產物經過重組後,產生一個脂肪酸甲酯(FAME)和二酸甘油酯(DG),如圖5-3-10所示。
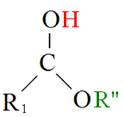
|
+ |
R’OH |
<-> |
|
|
<-> |
|
+ R”OH + H+ |
圖5-3-10 酸性催化劑下之轉酯化反應機制
5.3.3兩階段催化轉酯
大多數之生質柴油係以再精煉(refined)或可食用之油脂作為原料,利用甲醇與鹼性催化劑予以轉酯化製成,但部分之非食用性油、餐廳使用過之油炸油或動物性油脂,含有大量之游離脂肪酸,這些游離脂肪酸很容易在以鹼性催化劑為基礎之轉酯化反應過程中發生皂化現象,生成之皂除了影響反應速率、降低產出率外,也對反應後之生質柴油與甘油分離造成負面影響。針對這種低成本而含有多量游離脂肪酸之油脂原料,可採用兩階段轉酯方式來處理,在前處理階段,先以酸性催化劑將游離脂肪酸轉換成脂肪酸甲酯,然後再於第二階段中,採用鹼性催化劑完成轉酯化反應。
閱讀PDF......
|